アンチエイジング(抗加齢)医学とは,予防医学であり,長寿科学の 一部である。老化を疾患ととらえ,長寿研究を基礎に,学際的に,実践を通して,健康長寿を目指す領域である。
さらに,近年,山中因子を用いてリプログラミングすることで老化を逆転させる治療が行われ出した。このため,アンチエイジング医学の領域は,権能寿命延伸のため,また老化関連疾患への治療介入だけではなく,再生医療を使った真の若返りを目指す領域となった。
老化は遺伝子が関連しているものは20%程度で,80%程度は,環境因子といわれる。人類は,この100年ほどでは,最大寿命は120歳程度であまり変わらないが,平均寿命は急速に延ばしてきた。日本は,平均寿命が長いが,健康寿命との間に差がある。アンチエイジング(抗加齢)医学では,この差を少なくし,健康寿命の延伸を目指している。つまり一義的には,ピンピンコロリ(PPK)を目指すことになる。
1.寿命の観点から
2.老化は病気
3.アンチエイジング(抗加齢)医学の未来
4.加齢のサイエンスがさらに進む
5.ホルミシス仮説の発展
6.カロリーリストリクション(CR)ミメティックス
7.酸化ストレスコントロールの躍進
8.疾病治療としてのアンチエイジング医学
9.将来の展望
1.寿命の観点から1)
多くの生物種が,ある程度の暦年齢で死を迎えることがわかっている。寿命は,バイオレジリエ ンス(回復力)の消失であると考えられている。治療介入と適切なライフスタイルによって,60歳ごろまでは老化関連疾患を防ぐことができる。最も健康な人でも,最終的には,極端に虚弱で病気になり,その後死に至る。
寿命限界説では,死亡率に関するゴンペルツの法則(35~40歳以降では,年齢に対して死亡率は指数関数的に増大する。35歳以降8年ごとに2倍となるとされている)に従い,120~150歳が最大寿命の限界となる。生物学的回復力(跳ね返って回復する能力)の低下をいかにコントロールするか,フレイルへの対応をし続けて,健康寿命の延伸を行うのが基本的であろう。一方,山中4因 子でのリプログラミングを用いて,“若返り”をさせることが可能となり,バイオレジリエンスの低下を戻すことが可能となりつつあることから,次世代の寿命のとらえ方も考える必要があろう(図1)。長寿科学では,最大寿命に対しても挑戦していくことになろう。
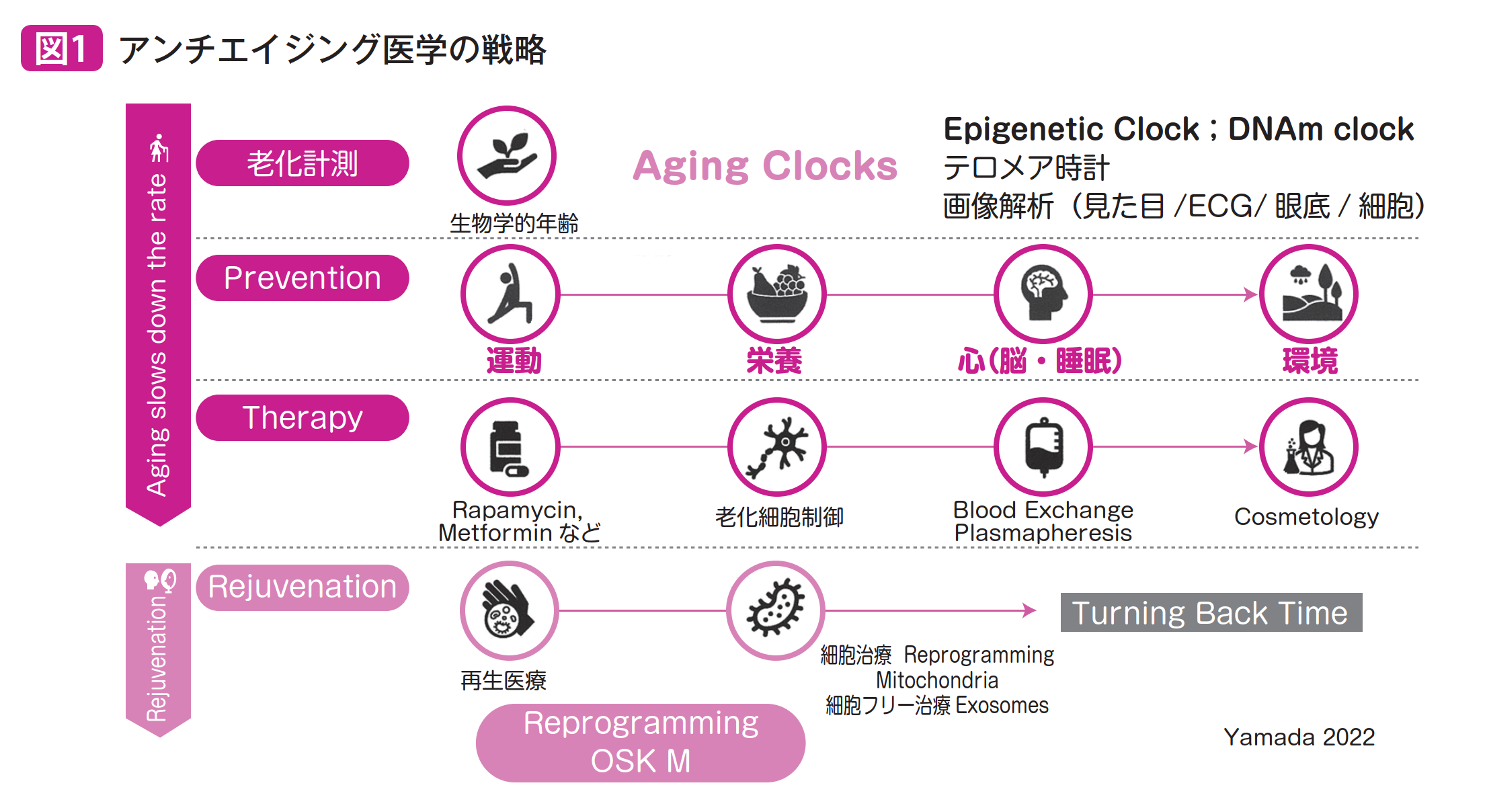
2.老化は病気2)
2022年からの国際疾病分類(International Statistical Classification of Diseases and Related Health Problems;ICD)11が採用された。この分類は,政策の立案,予算の決定,保険政策の決定など重要な公衆衛生の基準となる。ICD-11では,新しい拡張コードとして,XT9T;加齢関連 “age- related” がついた。XT9Tは,「高齢期における生物の適応と進歩の喪失を持続的にもたらす病的過程によって引き起こされる」ことを意味している。
次に関連するのは,MG2Aである。ICD-10には「老人性衰弱」とでもいうべきコードがあったが,ICD-11では,これに代わり,本来「老年」を意味するコードMG2Aが採用されることになった。 MG2Aは,もともと“old age”として定義されていたもので,議論の末3),定義が「老年期」から「加齢に伴う固有能力の低下」に変更され,「老年」は特定の病気ではなく,「一般的な症状」として分類された。長寿医学の立場では,MG2Aコードは,個人の年齢の定義が,年代から生物学的なものに変わるべきだったが、結局は,老化を病にするまでに至らなかった。高齢者にとって,若い人が治療を受けることができる健康問題を,年齢を理由に我慢する必要のない社会を作るべきであり, anti-ageismを進めるべきであろう。
近年の老化研究4)では,老化は,種を超えて保存された遺伝子にコードされて,これにepigeneticな環境因子が関係していることがわかってきた。老化の主だった特徴5);ゲノムの不安定性,テロメア の減少,エピジェネティックな変化,タンパク質恒常性の喪失,マクロオートファジーの無効化,栄養感知の調節解除,ミトコンドリアの機能不全,細胞の老化,幹細胞の枯渇,細胞間コミュニケーションの変化,慢性炎症,およびdysbiosisに従えば,細胞生物学で重要な経路(IGF-1/AKT/FOXO3A,TP53/P21/P16,mTOR/S6K)は,がんや糖尿病などの加齢に伴う疾患の原因ともいえる。
ケルセチンのようなサプリメントで老化細胞除去(セノリティクス)ができ,SIR-1SIR-6の活性を介してDNA修復,オートファジー,ミトコンドリア生合成,およびストレスとカロリー制限への応答の改善が可能となる。ミトコンドリアの移植治療や血漿交換療法や胸腺再生も老化を遅らせる。さらに,メトフォルミンやラパマイシンやスタチンのようなすでに医療承認が取れた薬剤で,疾患適応を転用して健康寿命を延伸できるか検討できるところまできている。このように,加齢と疾患経路に共通の分子への介入が健康寿命を延伸させると期待される。また,これらのアンチエイジング薬は,COVID-19の免疫低下に関しても使える可能性がある。
また特に,経時的な転写ネットワークとエピジェネティック情報の損失によると仮定する老化の情報理論は,運動・栄養・心(脳・睡眠)・環境に介入する予防医学の領域でも,例えば,DNAのメチル化を検討することで,短時間での変化を観察できる可能性がある。
今後は,老化をターゲットとして,適切なエンドポイントを設定した臨床治験が必要となる。そのためには老化時計ともよぶべき,“ヒトの老化進行度”の数値評価指標が必要である。治験のためには,精度が高く,短期間に有意差がつく,老化率の計測方法(バイオマーカー)の確立が重要である。日本抗加齢医学会が,予防医学,学際的,実践的を目指しているのは,このような立場からである。長寿医学の立場では,総合的な加齢変化をみて,よりよいケアを社会に提供すべきだろう。若い時代からの,運動・栄養・心(脳・睡眠)・環境への介入が,老化速度を遅くして,ウェルビーイングで,健康長寿を全うできる社会を目指すことになる。そして老化制御ができる時代を作っていくのが,長寿医療,アンチエイジング(抗加齢)医学の姿である。
(山田秀和)
文 献
1)Ferrucci L, Gonzalez-Freire M, et al: Measuring biological aging in humans: A quest. Aging Cell 2020; 19: e13080.
2)Khaltourina D, Matveyev Y, et al: Aging Fits the Disease Criteria of the International Classification of Diseases. Mech Ageing Dev 2020; 189: 111230.
3)Rabheru K, Byles J, et al: How “old age”was withdrawn as a diagnosis from ICD-11. The Lancet Healthy Longevity 2022; 3: e457-9.
4)Campisi J, Kapahi P, et al: From discoveries in ageing research to therapeutics for healthy ageing. Nature 2019; 571: 183-92.
5)López-Otín C, Blasco MA, et al: Hallmarks of aging: An expanding universe. Cell 2023; 186; 243-78.
日本抗加齢医学会認定テキスト「アンチエイジング医学の基礎と臨床 第4版」 P2-3
3.アンチエイジング(抗加齢)医学の未来
わが国の令和元年度(2019年度)の国民医療費は44兆3,895億円,前年度の43兆3,949億円に比べ9,946億円,2.3%の増加となっている。人口一人当たりの国民医療費は35万1,800円,前年度の34万3,200円に比べ8,600円,2.5%の増加となった。ジェネリック医薬品の積極的導入や後期高齢者医療制度の導入など対応をしても医療費の増大を抑制できない現状である。そのために予防医学の早急な導入が課題となっており,メタボリックシンドロームの撲滅はそのファーストステップと考えられている。従来のように病気になってから治療を開始する疾病治療中心型の医療政策から,病気になる前に介入を行うことができる医療政策へとシフトチェンジしていく必要がある。
アンチエイジング医学は加齢に焦点をあてた予防医学とも考えられ,現在のわが国の医療政策と一致する大きな医学の流れとなっている。エビデンスに基づいたアンチエイジング医学のためのエイジング理論としては現在,カロリーリストリクション(calorie restriction;CR)仮説と酸化ストレス仮説があり,実際これらを基にさまざまな介入が行われている1~4)。将来この流れはどのようになっていくのだろうか。
4.加齢のサイエンスがさらに進む
アンチエイジング医学のなかで,CR仮説と酸化ストレス仮説が大きな位置を占めるのは,これらの理論に基づいて実際の介入が可能であるからにほかならない5,6)。加齢のメカニズムのなかにはエピジェネティクス,遺伝子の損傷,老化細胞の増加,テロメアの短縮,タンパク質のクロスリンキングなどさまざまなものが絡んでいることは間違いないが,これらへの介入は現在の段階では難しい。将来はどうだろうか。
加齢のメカニズムがさらに解明され,新たな分子標的が多数見つかってくることは十分考えられることだ。CR仮説の中心に存在するサーチュイン,nicotinamide mononucleotide(NMN),nicotinamide riboside(NR)に加えてforkhead box(FOXO),mammalian target of rapamycin(mTOR),nuclear respiratory factor(NRF),ペルオキシソーム増殖因子活性化受容体(peroxisome proliferator-activated receptor;PPAR)-γ共役因子1(PGC1)など横綱級に重要な遺伝子候補が存在しており7~13),新たな介入の可能性も出てくるだろう。すでに現在においても,研究成果の発表については非常に慎重である米国国立老化研究所(National Institute on Aging;NIA)のde Cabo博士らは“The Search for Antiaging Interventions: From Elixirs to Fasting Regimens(アンチエイジング介入を求めて:不死の薬から断食介入まで)”というCell誌のレビューの中に厳しい条件を決めて現在アンチエイジング研究として認められるものを列挙している14)(表1)。条件とは,①寿命および健康寿命を延長させること,②少なくとも3種類の動物によって確かめられていること,そして③少なくとも世界中の3研究所で確かめられていることだ。これらの条件に合うものとして,CR,断食,運動,レスベラトロール,ラパマイシン,スペルミジン,メトホルミンの7つを挙げている。ほとんどCR仮説と関係するものであり,抗加齢医学研究の中心的テーゼがCR仮説から出ていることがこれからもよくわかる。
5.ホルミシス仮説の発展
CRや運動などアンチエイジング医学にプラスになる分子メカニズムとして現在注目されているのが“ホルミシス仮説”とよばれるものだ。ホルミシスとは生体にとって致死的ではないストレスが加わった場合,次のストレスへの応答性が改善することを指す。ちょっとつらい状態なら死んだりしないが,さらにつらい状態が押し寄せてきたときに耐性がついているという理論だ。運動によって活性酸素が発生することはよく知られている。活性酸素は加齢を促進するはずなのになぜ運動は身体によいのか? それは運動によって生じた活性酸素によって,活性酸素を除去する酵素群が発現されるからと考えられる。また運動によってミトコンドリアの機能が上がり,CRと同様な効果も得られるようになる15)。一時のストレスがトータルとしてよい結果を生む。逆に運動を1日中続けていればマイナスに働く可能性が出てくることはこの理論から容易に推測できる。
網膜の障害を見てみても,明るい光では光障害を生じる。しかしある程度の光を当てておけばnuclear respiratory factor 2(NRF2)などのストレス応答遺伝子が働き,カタラーゼなどの活性酸素除去のためのシステムを活性化して光障害を抑制する16)。これらの分子メカニズムがさらに発展すれば,単なる活性酸素を減らすビタミン類を摂取するばかりでなく,生体の防御反応を改善してアンチエイジングにつなげるという新しい介入方法がさらに開発されるだろう。

6.カロリーリストリクション(CR)ミメティックス
CRをしなくても,同じような効果を得たいという考えからさまざまな研究が行われている。一つの方法は厳格なCRをしなくてもCRと同じかさらに良い効果を上げようという考え方だ。カリフォルニア大学のボルター・ロンゴ教授は基礎研究から始まり臨床応用まで含めてfasting mimicking diet(FMD)という概念を提唱している17~19)。ヒトでは1カ月のうちの5日間だけカロリーを50%程度に抑え,この間特にタンパク質と炭水化物の接種を抑えるというものだ。これによってCRのマイナスである体温低下や,骨筋肉の低下,幸福度の低下などを抑えながらCRのプラスの効果を享受できる。さらにはステムセルの若返りまで行える可能性も示されており注目が集まっている20)。もうひとつの方法はCRミメティックスといい,サプリメントや薬剤で起こしていく方法だ21)。このなかで現在注目されているものがレスベラトロールおよびレスベラトロール関連物質だ。CRによってサーチュインが活性化することが長寿遺伝子発現の1つの大きな経路と考えられているので,サーチュインを活性化することができるレスベラトロールを摂取して同じ効果を得ようとするものである。すでにレスベラトロールの1,000倍以上の効果のある物質まで開発されており,将来この領域は大きく発展するものと思われる22,23)。
さらに,サーチュインはnicotinamide adenine dinucleotide(NAD)依存性の酵素であるため,NAD濃度を高める方法が提唱され始めた。1つは前駆物質を与えるものであり,NMNやNRの2つが有望視されている。もう1つはNADを競合的に使うpoly ADP-ribose polymerase(PARP)酵素の阻害剤の使用である。NRはすでに米国ではサプリメントとして販売されており大きな期待が寄せられている。
また,CRミメティックスとしてケトン体の応用も期待されている。ケトン体のなかでも特にhydroxybutyrat(eHBA)24,25)はFOXOやinflammasomeを介して酸化ストレス,炎症をコントロールすると期待されている。筆者らもHBA点眼を,局所投与におけるCRミメティックスと位置付けてアンチエイジング医学を応用した治療薬剤の開発を行っている。
7.酸化ストレスコントロールの躍進
糖尿病ひとつをとってみても,高血糖による障害のほとんどすべては酸化ストレスによる障害と考えられている。一見関係のなさそうな4つの有名な経路すべてに活性酸素が関連する26)(図1)。だとすれば,酸化ストレスを抑制するようなビタミンA,C,Eやさまざまなサプリメントが糖尿病による合併症の予防に効果があるはずであるが,まだ決定的な酸化ストレスコントロールによる治療法は開発されていない。これは,十分な酸化ストレス制御を行える物質の開発がまだなされていないからと考えられる。また,酸化ストレスは細胞内のシグナルとしても使われているため27),むやみに過酸化水素などを消去せず,障害を起こすヒドロキシラジカルなどを選択的に消去する方法,例えば水素水などを利用する方法などがさらに開発されていくと期待される。
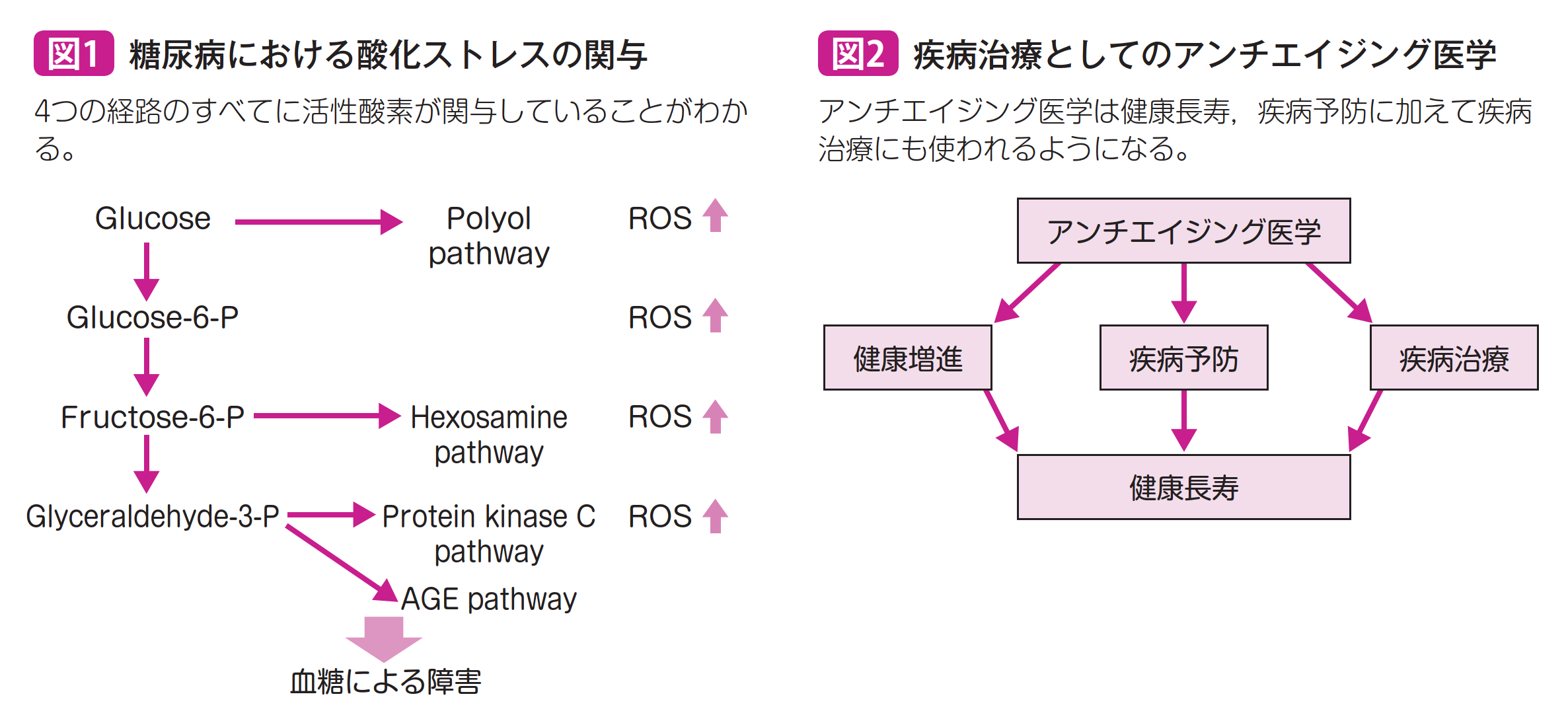
8.疾病治療としてのアンチエイジング医学
CRミメティックスにしても,酸化ストレスコントロールにしても,従来はアンチエイジングというある意味漠然とした目標に対して開発されていたが,最近の大きな考え方のシフトとして,アンチエイジング医学を疾病治療として使おうという考え方が出てきている(図2)。予防医学を超えて疾病治療医学にアンチエイジング医学を使おうという画期的な考え方だ。実際に,レスベラトロールはもともとサーチュインを活性化するという酵母,線虫の加齢研究から開発されたものであるが,2008年にミトコンドリア脳筋症に対するオーファンドラッグとして米国食品医薬品局(Food and Drug Administration;FDA)の認可を得ている。NMN,NRや,活性酸素が関与する老人性難聴やドライアイなどに対しても,酸化ストレスコントロールによって治療ができないかどうか模索されている28~30)。
9.将来の展望
アンチエイジング医学の未来は明るい31)。予防医学として重要な地位を確立するのみでなく疾病治療の一環にも組み込まれるだろう。ただし,まだまだハードルもある。1つは,サーチュインなどの長寿遺伝子は体細胞の老化を抑える働きがあるものの,哺乳類にある7つのサーチュインの一部はがん細胞の老化も抑えたり,がん細胞を抗がん剤から守るなど,生体全体にマイナスに働くこともわかってきたからだ。抗酸化サプリメントにしても過剰摂取は必要な酸化ストレスをもなくしてしまう可能性があり,各個人によっての必要量を決めることが大切となってきた。しかしながら,抗加齢医学の未来は明るい。エイジングのメカニズムが解明されるにつれてNADの濃度を上げたり,ケトン体の濃度を上げたり,FMDを導入したりと比較的簡便で廉価なアンチエイジングの方法が視野に入ってきたからだ18,32)。現在においても毎年数カ月分の寿命の延長がみられているが,これをさらに積極的に推し進めて日本人,いや人類全体の寿命の延長につながれば社会的インパクトは非常に大きい。というのは,現在の国内総生産(GDP)の増大のかなりの部分が寿命の延長によってもたらされていることは間違いなく33),また予防医学により疾病に至ってから治療する費用から離脱できれば経済効果も期待できる。個人だけでなく社会にとってもさらに重要な医学になっていくものと考えられる。さらに最近は,哺乳類において,アンチエイジングだけではなくリバースエイジング(若返り)がエピジェネティックを操作することによって可能であることをわれわれは報告34)した。これによってさらに新たな時代がやってくる可能性がある。
(坪田一男)
文 献
1)Kirkwood TB: Understanding the odd science of aging. Cell 2005; 120: 437-47.
2)Kenyon C: The plasticity of aging: insights from long-lived mutants. Cell 2005; 120: 449-60.
3)Kennedy BK, Smith ED, et al: The enigmatic role of Sir2 in aging. Cell 2005; 123: 548-50.
4)Hadley EC, Lakatta EG, et al: The future of aging therapies. Cell 2005; 120: 557-67.
5)Roth GS, Lane MA, et al: Biomarkers of caloric restriction may predict longevity in humans. Science 2002; 297: 811.
6)Khaw KT, Wareham N, et al: Combined impact of health behaviours and mortality in men and women: the EPIC-Norfolk prospective population study. PLoS Med 2008; 5: e12.
7)Wang MC, Bohmann D, et al: JNK extends life span and limits growth by antagonizing cellular and organism-wide responses to insulin signaling. Cell 2005; 121: 115-25.
8)Essers MA, de Vries-Smits LM, et al: Functional interaction between beta-catenin and FOXO in oxidative stress signaling. Science 2005; 308: 1181-4.
9)Hwangbo DS, Gershman B, et al: Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body. Nature 2004; 429: 562-6.
10)Brunet A, Sweeney LB, et al: Stress-dependent regulation of FOXO transcription factors by the SIRT1 deacetylase. Science 2004; 303: 2011-5.
11)Liu Y, Kern JT, et al: A genomic screen for activators of the antioxidant response element. Proc Natl Acad Sci USA 2007; 104: 5205-10.
12)Jäger S, Handschin C, et al: AMP-activated protein kinase ( A M P K ) a c t i o n i n s k e l e t a l m u s c l e v i a d i r e c t phosphorylation of PGC-1alpha. Proc Natl Acad Sci USA 2007; 104: 12017-22.
13)Yamauchi T, Noi Y, et al: Targeted disruption of AdipoR1 and AdipoR2 causes abrogation of adiponectin binding and metabolic actions. Nat Med 2007; 13: 332-9.
14)de Cabo R, Carmona-Gutierrez D, et al: The Search for Antiaging Interventions: From Elixirs to Fasting Regimens. Cell 2014; 157: 1515-26.
15)Schulz TJ, Zarse K, et al: Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress. Cell Metab 2007; 6: 280-93.
16)Tanito M, Masutani H, et al: Sulforaphane induces thioredoxin through the antioxidant-responsive element and attenuates retinal light damage in mice. Invest Ophthalmol Vis Sci 2005; 46: 979-87.
17)Minhas PS, Latif-Hernandez A, et al: Restoring metabolism of myeloid cells reverses cognitive decline in ageing. Nature 2021; 590: 122-8.
18)Longo VD, Anderson RM: Nutrition, longevity and disease: From molecular mechanisms to interventions. Cell 2022; 185: 1455-70.
19)Vernieri C, Fucà G, et al: Fasting-Mimicking Diet Is Safe and Reshapes Metabolism and Antitumor Immunity in Patients with Cancer. Cancer Discov 2022; 12: 90-107.
20)Cheng CW, Villani V, et al: Fasting-Mimicking Diet Promotes Ngn3-Driven β-Cell Regeneration to Reverse Diabetes. Cell 2017; 168: 775-88.e12.
21)Curtis R, Geesaman BJ, et al: Ageing and metabolism: drug discovery opportunities. Nat Rev Drug Discov 2005; 4: 569-80.
22)Milne JC, Lambert PD, et al: Small molecule activators of SIRT1 as therapeutics for the treatment of type 2 diabetes. Nature 2007; 450: 712-6.
23)Baur JA, Pearson KJ, et al: Resveratrol improves health and survival of mice on a high-calorie diet. Nature 2006; 444: 337-42.
24)Izuta Y, Imada T, et al: Ketone body 3-hydroxybutyrate mimics calorie restriction via the Nrf2 activator, fumarate, in the retina. Aging Cell 2018; 17: e12699.
25)Nakamura S, Hisamura R, et al: Fasting mitigates immediate hypersensitivity: a pivotal role of endogenous D-beta-hydroxybutyrate. Nutr Metab (Lond) 2014, 11: 40
26)Brownlee M: Biochemistry and molecular cell biology of diabetic complications. Nature 2001; 414: 813-20.
27)Veal EA, Day AM, et al: Hydrogen peroxide sensing and signaling. Mol Cell 2007; 26: 1-14.
28)Imai S, Guarente L: NAD+ and sirtuins in aging and disease. Trends Cell Biol 2014; 24: 464-71.
29)Brown KD, Maqsood S, et al: Activation of SIRT3 by the NAD+ precursor nicotinamide riboside protects from noise-induced hearing loss. Cell Metab 2014; 20: 1059-68.
30)Brenner C: Boosting NAD to spare hearing. Cell Metab 2014; 20: 926-7.
31)Fontana L, Partridge L, et al: Extending healthy life span-from yeast to humans. Science 2010; 328: 321-6.
32)Shimazu T, Hirschey MD, et al: Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor. Science 2013; 339: 211-4.
33)Scott AJ, Ellison M, et al: The economic value of targeting aging. Nat Aging 2021; 1: 616-23.
34)Yang JH, Hayano M, et al: Loss of epigenetic information as a cause of mammalian aging. Cell 2023; 186: 305-26.
日本抗加齢医学会認定テキスト「アンチエイジング医学の基礎と臨床 第4版」 P27-30





